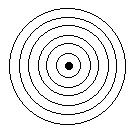
On doit à un physicien danois Niels Bohr la 1ère représentation de l'atome. Les e- se répartissent en différentes couches électroniques et tournent autour du noyau central.

On désigne les différentes couches renfermant les e- par les lettres K, L, M, N, Q, P en partant du noyau.
On appelle structure électronique la répartition des e- dans les différentes couches.
Pour observer la structure électronique des principaux atomes, on utilise un tableau.
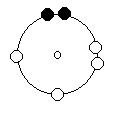
L'Oxygène (O, Z= 8) : 1s2, 2s2, 2p4 sont modèle atomique sera:
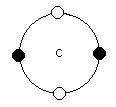
Le Carbone (C, Z= 6) : 1s2; 2s2, 2p2 sont modèle atomique sera:
Cette structure électronique est très simple et comporte pas mal d'exceptions.
Cu, Ag, Au avec retour à la couche précédente (pour des raisons de symétrie...).
Cu (Z= 29) : 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d9
devient : 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d10
 |
 |