|
Electrolyse
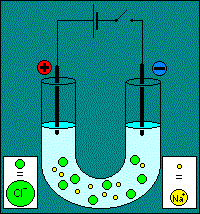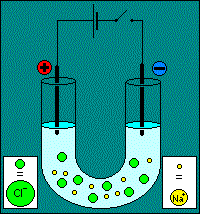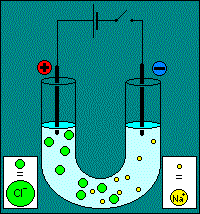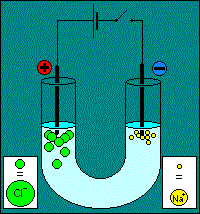
Première phase : migration L'exemple choisit pour l'animation est celui de l'électrolyse d'une solution de chlorure de sodium. On y constate la migration des ions selon leur affinité électrostatique :
Remarque : il y a une erreur sur l'animation : l'interrupteur du circuit reste ouvert. Deuxième phase : réactions Les réactions aux électrodes se produisent grâce aux électrons apportés par l'intensité débitée par le générateur de tension. Réaction à la cathode. La cathode est négative, elle est riche en électrons, on va assister à une réaction de réduction : Ox1 + e- = Réd1 Réaction à l'anode. L'anode est positive, elle consomme des électrons, on assiste à une réaction d'oxydation : Réd2 = Ox2 + e-. Attention !
Le principe contraire de l'électrolyse est la pile. |
 L'électrolyse est l'opération qui
consiste à imposer un courant électrique dans une solution. Cette
solution peut être une solution aqueuse, un solvant voire un sel
fondu.
L'électrolyse est l'opération qui
consiste à imposer un courant électrique dans une solution. Cette
solution peut être une solution aqueuse, un solvant voire un sel
fondu.